date:2025-06-09 10:09:48
引言
類器官可能看起來像簡單的細胞團塊,但它們正在改寫疾病建模的規則。在世界各地的實驗室中,微小的3D人類細胞團正在自我組織成類似于微型器官的結構——揭示了組織發育、功能和衰竭的復雜性[1]。歡迎來到類器官的世界:自我組織的3D細胞培養,它們正在重塑我們研究人類生物學和疾病的方式。
類器官不僅僅是2D培養的技術改進——它們是一種范式轉變。它們既提供了體內模型的結構復雜性,又保留了體外實驗的可及性。對于研究阿爾茨海默病背后機制、測試結直腸癌藥物反應或模擬病毒感染影響的研究人員來說,類器官提供了一個獨特的窗口來觀察生命系統,而無需離開實驗室工作臺。
是什么讓類器官如此獨特?
類器官最重要的貢獻之一是它們能夠作為更準確的疾病模型。通過密切模擬人類組織的細胞復雜性和功能,類器官彌合了簡化的體外模型和復雜的體內系統之間長期存在的差距。傳統的2D培養通常無法捕捉組織的三維組織,而動物模型在代表人類特異性反應方面可能存在不足。然而,類器官提供了一個折中方案——既具有體外系統的可擴展性,又具有更接近人體器官的生理相關性[2]。
類器官真正令人興奮的地方在于它們能夠自我組織成不僅反映真實組織的結構,而且反映其發育動態的結構。這不僅僅是模仿外觀——它們還表現出行為和反應,為我們了解人類器官如何形成、適應或功能障礙提供了一個窗口。它們在具有多因素原因和復雜組織相互作用的疾病中具有重要意義。
類器官可以源自多種細胞來源,包括患者特異性干細胞、成人組織干細胞,甚至腫瘤活檢。這種多功能性既可以實現個性化的疾病建模,也可以實現對發育和病理的標準化研究。
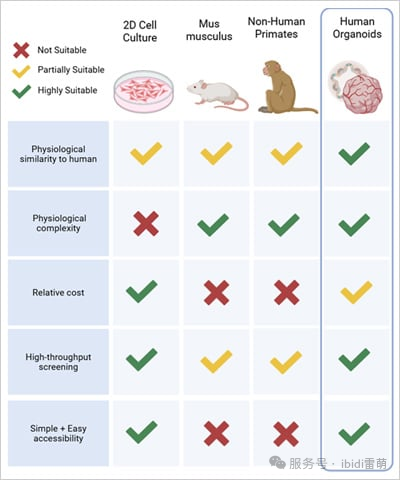
圖1|類器官與其他模型系統的比較。改編自Sun, X., et al.,2023 [3]
類器官的應用
類器官比傳統模型提供更高的臨床保真度,并且具有成本效益和效率,從而能夠更準確地進行疾病模擬和快速的藥物功能測試。目前,類器官主要用于四個關鍵領域:
1.疾病建模
類器官已成為研究器官發育和疾病機制的有力工具,其環境與人類生理非常相似。它們源自患者組織或多能干細胞,保留了原生的遺傳和功能特征,因此非常適合研究從神經發育和傳染病到代謝紊亂和癌癥的廣泛疾病。
在癌癥研究中,腫瘤來源的類器官保留了原始腫瘤的遺傳異質性和結構,包括與基質細胞和免疫細胞的相互作用。這使得研究人員能夠以患者特異性的方式探索腫瘤進展、侵襲和耐藥性的機制。類器官已被證明在重現復雜的腫瘤微環境方面特別有用,并且現在被用于實時預測治療反應[4]。
在神經系統疾病領域,大腦類器官能夠研究人類大腦發育、突觸形成和神經炎癥——這些過程在動物中難以建模[5]。它們提供了對諸如阿爾茨海默病、自閉癥譜系障礙、癲癇和小頭畸形等疾病的見解。 值得注意的是,大腦類器官可以重現諸如tau聚集和淀粉樣斑塊發育等特征,從而為研究神經退行性疾病和測試靶向療法提供了一個生理相關的平臺。
它們具有模擬早期疾病過程、組織特異性病理和患者變異性的能力,這使得類器官對于發現疾病機制、識別新的治療靶點以及在與人類相關的條件下驗證實驗性干預措施具有不可估量的價值。
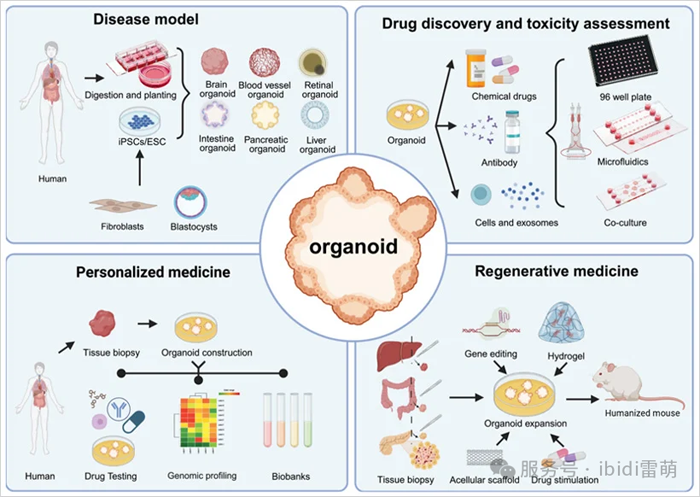
圖2|類器官的四個主要應用。改編自Sun, X., et al.,2023 [6]
2.藥物發現赫毒性篩選
制藥行業面臨著巨大的壓力,需要在降低開發成本的同時,找到安全有效的藥物。類器官通過提供可擴展的、高通量的平臺來模擬真實組織反應,從而提供了一種解決方案[7]。研究人員現在可以在患者來源的類器官模型中篩選數百種化合物,以評估治療潛力和毒性。例如,肝臟和腎臟類器官被用于檢測脫靶效應,而腫瘤類器官被用于預測對化療或靶向藥物的反應。將這些分析與微流控和人工智能驅動的成像分析相結合,可進一步提高通量和精確度。
3.再生醫學
類器官不僅僅是模型——它們是組織替代的藍圖。它們在再生醫學中的應用包括重建受損組織、支持器官修復以及潛在地作為可移植的構建塊。生物打印、支架工程以及與免疫或血管細胞共培養系統的進步已經突破了可能的界限。雖然臨床應用仍處于早期階段,但來自腸道、視網膜和肝臟組織的類器官已在臨床前模型中顯示出恢復喪失的功能和逆轉退化的前景[8]。
4.個性化醫療
類器官最具變革性的應用之一是為個體患者量身定制治療方案。通過培養來自患者來源組織的類器官,臨床醫生可以在給藥前在體外測試藥物療效和耐藥性。這種方法已經在結直腸癌、乳腺癌和胰腺癌等癌癥中顯示出臨床價值,其中腫瘤異質性通常導致不同的治療結果。例如,在囊性纖維化中,當僅靠遺傳學不足以指導治療決策時,基于類器官的分析已指導了治療決策。為了說明這種方法的影響,讓我們看一個真實的例子:
案例研究:囊性纖維化和個性化藥物測試[9]
類器官應用的一個引人注目的真實案例可以在囊性纖維化(CF)研究中找到。科學家們從患者干細胞中培育出腸道類器官,并利用功能性膨脹分析來評估CFTR調節藥物的有效性。這些類器官會因離子和水的流入而膨脹,從而對有效治療做出反應——這是藥物起效的直接視覺提示。
這種分析使臨床醫生能夠預測具有罕見或知之甚少的CFTR突變的個體的藥物反應。在許多病例中,它為個性化治療提供了指導,而在這些病例中,僅靠基因檢測并不能提供明確的治療方案。該模型說明了類器官在藥物測試中的強大作用,并展示了其在精準醫療中的臨床實用性。
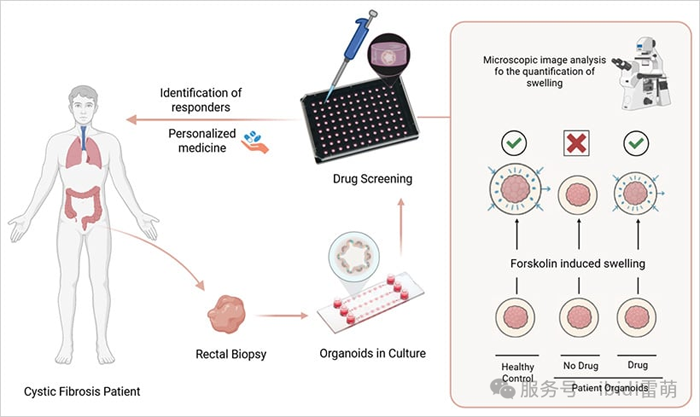
圖3|評估患者來源的類器官中的CFTR功能
賦能技術:智能平臺的作用
類器官研究在很大程度上依賴于支持性技術,就像依賴于細胞本身一樣。現代平臺能夠實現精確的凝膠處理、長期灌注和先進的成像——所有這些對于可重復且生理相關的實驗至關重要。
像 µ-Slide Spheroid Perfusion 這樣的微流控工具提供可控的流動來模擬體內條件,支持對生長、藥物反應和組織結構的實時研究。
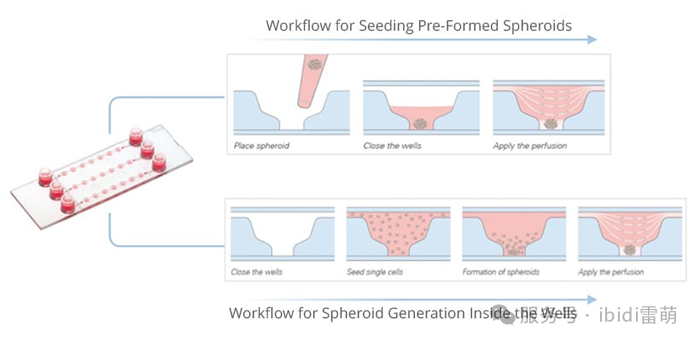
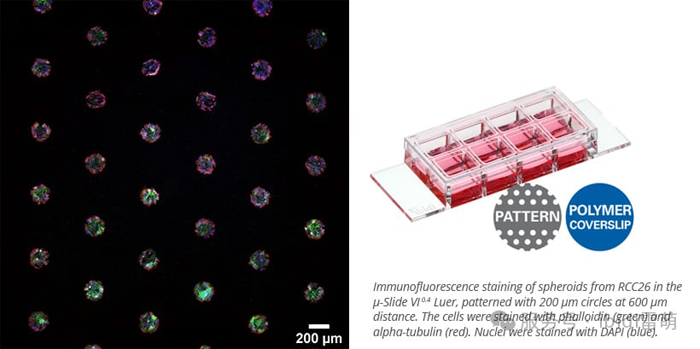
ibidi 的 µ-Patterning 技術可利用帶有圖案點的非粘性表面實現空間定義的細胞粘附。這種設置非常適合生成均勻的球體、研究細胞行為或使用高分辨率成像進行CAR-T細胞殺傷測定。
最后,µ-Plate 96 Well 3D 將高通量能力與最小的凝膠使用量和卓越的光學質量相結合——使其成為以標準化、高效的方式進行篩選、3D細胞培養和實時成像的理想選擇。
超越單一類器官:組裝類器官系統
雖然傳統的類器官提供了對單個器官行為的見解,但許多人類疾病涉及多個組織之間的串擾。這導致了多器官類器官系統(也稱為組裝類器官)的出現,該系統結合了不同的類器官——例如大腦-脊髓或腸道-肝臟——以更好地復制生理相互作用。這些模型越來越多地用于在單個平臺上研究發育、全身藥物效應、激素信號傳導和免疫-器官通訊。它們的復雜性為模擬跨越多個器官系統的疾病和構建更全面的芯片上身體平臺開辟了新的可能性。
最近的一個例子涉及一個心腎單元,其中來自hiPSC的心臟和腎臟類器官在微流控芯片上組合在一起[10]。使用 µ-Slide III 3D 灌注,研究人員在靜態和流動條件下保持了兩種類器官的結構和功能完整性。該系統證明了灌注下類器官共培養如何能夠支持未來對器官間信號傳導和疾病機制的研究——使該領域更接近完全集成的器官水平建模。
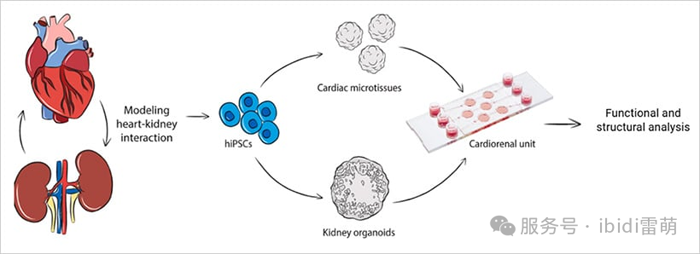
圖4|用于研究器官間串擾的雙類器官系統[10]
結論
隨著科學不斷突破我們可以在人體外復制的界限,類器官正處于創新的前沿。這些微小的、類似器官的細胞團正在幫助科學家完成從疾病建模到新藥測試的所有工作,而這一切都離不開實驗室。
隨著我們不斷改進這些模型并開始將AI、組學和生物工程融入其中,我們正朝著一個個性化的、器官水平的洞察力從實驗室到臨床床邊塑造醫學的未來邁進。
要了解更多關于球狀體、類器官和3D細胞培養的信息,可查看(ibidi雷萌)公眾號中的3D細胞培養合集,或聯系我們索要3D細胞培養應用指南。
參考文獻:
[1] Yi, S.A., et al., Bioengineering Approaches for the Advanced Organoid Research. Adv Mater, 2021. 33(45): p. e2007949.
[2] Kim, J., B.-K. Koo, and J.A. Knoblich, Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology, 2020. 21(10): p. 571-584.
[3] Sun, X., et al., A narrative review of organoids for investigating organ aging: opportunities and challenges. Journal of Bio-X Research, 2023. 06(01): p. 3-14.
[4] Fang, Z., et al., The role of organoids in cancer research. Experimental Hematology & Oncology, 2023. 12(1): p. 69.
[5] Birtele, M., M. Lancaster, and G. Quadrato, Modelling human brain development and disease with organoids. Nature Reviews Molecular Cell Biology, 2025. 26(5): p. 389-412.
[6]Yao, Q., et al., Organoids: development and applications in disease models, drug discovery, precision medicine, and regenerative medicine. MedComm, 2024. 5(10): p. e735.
[7] Vandana, J.J., et al., Human pluripotent-stem-cell-derived organoids for drug discovery and evaluation. Cell Stem Cell, 2023. 30(5): p. 571-591.
[8] Wu, Y., et al., Application of Organoids in Regenerative Medicine. Stem Cells, 2023. 41(12): p. 1101-1112.
[9] Dekkers, J.F., et al., Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis. Science Translational Medicine, 2016. 8(344): p. 344ra84-344ra84.
[10] Gabbin, B., et al., Heart and kidney organoids maintain organ-specific function in a microfluidic system. Mater Today Bio, 2023. 23: p. 100818.
ICP備案號:
滬ICP備15057650號-1
 滬公網安備31011202005471
滬公網安備31011202005471
雷萌生物科技(上海)有限公司 保留所有版權.