date:2025-05-12 10:12:22
想象一下,你的膝蓋受傷了。幾乎瞬間,你的身體就會啟動修復機制:皮膚細胞遷移以閉合傷口,免疫細胞涌入抵抗感染,血管重組以恢復循環。從胚胎發育的早期階段到受損組織的再生,細胞遷移是塑造生命本身的核心過程。
細胞并非隨機移動——它們遵循精確的信號,以驚人的準確性在組織中穿行。這種遷移能力支撐著器官形成、傷口愈合和免疫防御等關鍵生物學功能。然而,當這種嚴格調控的機制失控時,可能引發慢性炎癥、自身免疫疾病甚至癌癥[1]。
那么,細胞是如何知道該去哪里的?它們如何移動?科學家們如何研究和操縱這些機制,以更好地了解健康和疾病?讓我們一起深入探索細胞遷移這一奇妙的世界。
細胞如何移動?為何移動?
細胞雖不會“行走”,但其內部擁有復雜的骨架系統,通過延伸和收縮驅動自身穿過組織。它們的運動高度協調,受外部信號和內部信號級聯調控。廣義上,細胞遷移機制可分為三類[2]:
•阿米巴樣遷移:細胞通過偽足狀突起擠過縫隙,類似阿米巴運動。
•間充質遷移:細胞黏附周圍結構,利用富含肌動蛋白的片狀偽足(lamellipodia)和絲狀偽足(filopodia)牽引自身前進。
•集體遷移:細胞群作為協調單元共同移動,在傷口愈合和胚胎發育中至關重要。
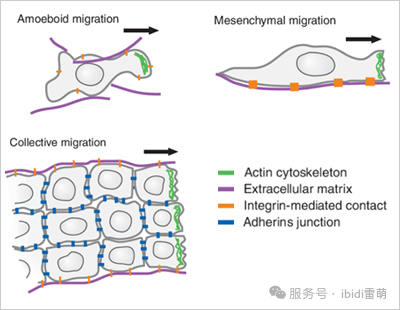
遷移策略的多樣性
細胞遷移在發育和愈合中的作用
從生命的最初階段起,細胞就處于運動狀態。在發育中的胚胎內,神經嵴細胞通過長距離遷移形成心臟、骨骼和神經系統等結構。若缺乏精確的遷移,將導致出生缺陷和發育障礙。這種高度協調的過程確保器官和組織在正確的時間與位置發育,從而塑造機體的結構與功能[3]。
在生命后期,細胞遷移成為傷口愈合和組織再生的核心機制。當組織受損時,角質形成細胞、成纖維細胞與免疫細胞協同修復損傷。成纖維細胞遷移至傷口處沉積膠原蛋白以形成新組織,內皮細胞通過血管生成新血管以恢復氧氣和營養供應[4]。免疫細胞在趨化性引導下涌入損傷部位,對抗感染、清除碎片并調節炎癥[5]。這種復雜的細胞協作確保了高效愈合,同時避免慢性傷口或過度疤痕形成。
通過研究發育和愈合中的細胞遷移,科學家得以深入理解細胞如何在其微環境中導航、響應信號并協調運動。Live-cell imaging 活細胞成像技術使研究者能夠實時觀察這些微小“旅行者”,捕捉細胞如何推動、拉動與協作以構建組織并修復損傷。這些發現不僅揭示了有序遷移的精妙,也展現了失控后的后果——盡管精準遷移對器官構建和傷口愈合至關重要,但細胞的移動能力也可能走向極端:例如在癌癥中,失控的細胞掙脫束縛并侵襲新領域。
黑暗面:癌癥轉移與失控的遷移
雖然受控的遷移對于生命至關重要,但細胞的移動能力也可能導致致命的疾病。癌癥最令人恐懼的方面之一是轉移,即腫瘤細胞脫離、通過血液或淋巴系統傳播并在遠處器官中建立繼發性腫瘤的過程[6]。癌細胞利用許多與正常細胞相同的機制,但帶有一種危險的轉變:
•上皮-間充質轉化(EMT):增強運動性以脫離原發腫瘤。
•無視停止信號:突破組織屏障。
•劫持血管生成:利用新生血管作為轉移通道[7]。這些新血管為癌細胞通過身體遷移提供了直接途徑,使它們能夠進入遠處器官,在那里它們可以建立繼發性腫瘤并推動疾病進一步發展。
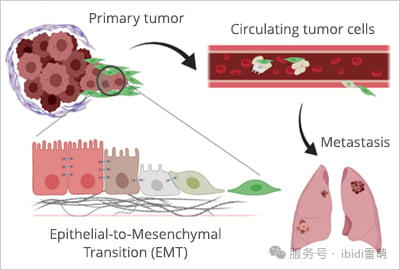
癌癥轉移中的失控遷移
細胞遷移與癌癥之外的疾病
雖然癌癥轉移是不受控制的遷移最臭名昭著的例子,但異常的細胞運動也與以下其他疾病有關:
•炎癥性疾病:在類風濕性關節炎和哮喘等疾病中,免疫細胞過度遷移,導致慢性炎癥和組織損傷。
•神經退行性疾病:發育過程中神經元的異常遷移與癲癇和精神分裂癥等疾病有關[8]。
•纖維化:當成纖維細胞過度侵襲性遷移時,過多的疤痕組織會在肺(肺纖維化)或肝臟(肝硬化)等器官中形成,從而損害功能[9]。
科學家如何研究細胞遷移?
研究細胞遷移對于理解關鍵生物學過程至關重要,包括組織修復、免疫反應和癌癥轉移。然而,傳統的遷移分析通常面臨重現性、生理相關性和實時觀察方面的挑戰。研究人員不斷改進方法,以克服這些局限性并更深入地了解細胞運動。
傷口愈合實驗
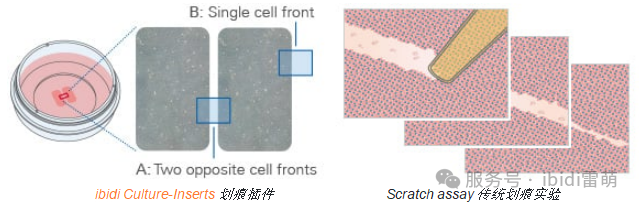
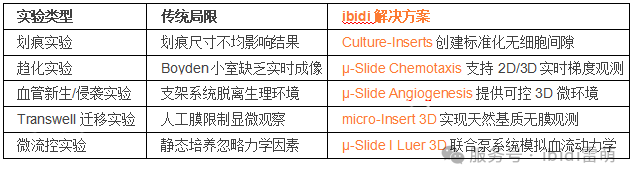
傷口愈合分析用于研究細胞如何遷移以閉合間隙,模擬體內組織修復過程。該技術廣泛應用于再生、纖維化和腫瘤細胞遷移的研究。然而,傷口大小和形狀的不一致會導致結果的可變性,而機械刮擦可能會影響細胞行為。使用明確的無細胞間隙代替手動刮擦有助于確保更具可重復性和可量化的傷口愈合實驗。
ibidi解決方案:與傳統的劃痕實驗相比,ibidi Culture-Inserts劃痕插件可創建精確、無細胞和無碎屑的間隙。這使得不同傷口愈合和細胞遷移實驗具有出色的可重復性和準確的可比性。
趨化性實驗
趨化性分析檢查細胞如何響應化學梯度移動,在免疫反應、胚胎發育和癌癥轉移中發揮著至關重要的作用。
傳統方法:Boyden小室缺乏實時可視化,從而將分析限制為終點測量,并且提供的關于遷移模式的見解有限。
ibidi解決方案:µ-Slide Chemotaxis細胞趨化載玻片提供在2D和3D環境中進行實時趨化性測量,從而可以在受控梯度下詳細觀察細胞運動。這使得研究人員能夠連續跟蹤遷移動態,從而提供更準確和定量的定向運動和細胞行為分析。

µ-Slide Chemotaxis
出芽和侵襲實驗
出芽和侵襲分析用于研究細胞如何侵入周圍組織,這是血管生成、癌癥轉移和組織重塑中的一個重要過程。在出芽分析中,內皮細胞形成新的毛細血管樣結構,模擬血管形成。在侵襲分析中,癌細胞或基質細胞遷移到3D基質中,復制腫瘤浸潤。
傳統方法:通常依賴于復雜的共培養系統或人工支架,可能無法完全復制生理條件。
ibidi解決方案:µ-Slide Angiogenesis和micro-Insert 3D為在特定條件下研究細胞出芽和侵襲提供了可控的環境,ibidi的這些系統支持高分辨率成像,使研究人員能夠在更具生理相關性的環境中分析血管形成和腫瘤細胞侵襲的動態。

Transwell遷移實驗
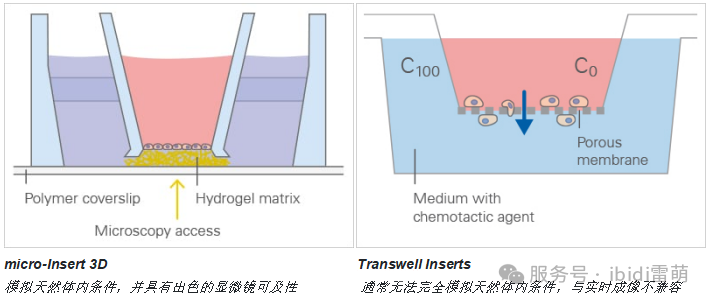
Transwell遷移分析通常用于研究細胞如何穿過多孔膜,模擬諸如血腦屏障或內皮層之類的組織屏障。它經常應用于癌癥研究、免疫學和藥物測試。雖然傳統的Transwell分析對于研究細胞遷移有效,但它們可能無法完全復制天然體內條件的復雜性,因為它們通常使用不能完全模擬細胞外基質或組織結構的人工膜。此外,這些分析可能會限制顯微鏡的可及性和可視化,從而阻礙對細胞行為的實時觀察。
ibidi解決方案:micro-Insert 3D提供了一種更相關且更易于訪問的替代方案,提供了一種天然的3D環境,無需使用人工膜,從而可以更好地進行顯微鏡觀察,并準確觀察在更接近天然組織條件下的細胞侵襲和遷移。
微流控實驗
微流控系統使研究人員能夠研究流體流動和剪切應力如何影響細胞遷移——這些因素在血管生物學、轉移和組織工程中起著至關重要的作用。傳統的靜態培養條件無法復制這些動態環境,從而限制了遷移研究的生理相關性。整合了受控流動條件的實驗裝置可幫助研究人員分析剪切應力和間質流動如何影響細胞運動和粘附。
傳統靜態培養無法模擬血流剪切力。
ibidi解決方案:µ-Slide I Luer 3D載玻片與ibidi Pump System泵系統相結合,能夠對細胞的穿膜遷移進行可控研究。將內皮細胞置于管腔側,癌細胞置于基底層側,模擬體內條件,可施加剪切應力以進行真實的流體流動研究。
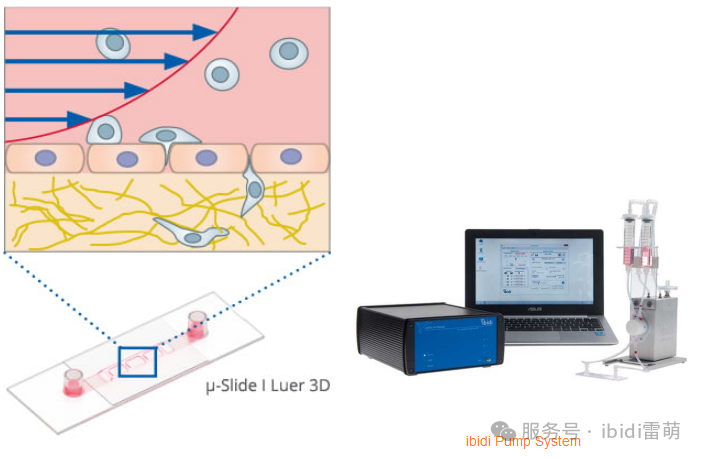
研究細胞遷移ibidi解決方案與傳統方法對比的凸顯優勢
細胞遷移研究的未來展望
細胞遷移是生物學中最基本但又最復雜的過程之一。它決定了我們如何發育、如何愈合,以及 ——當出現問題時——疾病如何發展。通過研究這一復雜的過程,研究人員可以解鎖從傷口愈合到癌癥治療的各種新療法。
借助先進的活細胞成像、micropatterned environments微圖案化環境[10]和微流控系統等前沿工具,科學家們現在能夠以前所未有的精度觀察和操控細胞遷移。這些技術正在為未來的發現鋪平道路,也許有一天,它們將幫助我們阻止癌癥的發展,加速組織再生,并更好地理解細胞層面的生命奧秘。
在我們繼續探索細胞的 “大逃亡” 時,有一點是明確的:理解遷移不僅僅是觀察細胞的移動 —— 而是要揭開生命本身的奧秘。
參考文獻
[1] Pourjafar, M. and V.K. Tiwari, Plasticity in cell migration modes across development, physiology, and disease. Frontiers in Cell and Developmental Biology, 2024. 12.
[2] Kunwar, P.S., D.E. Siekhaus, and R. Lehmann, In vivo migration: a germ cell perspective. Annu Rev Cell Dev Biol, 2006. 22: p. 237-65.
[3] Kurosaka, S. and A. Kashina, Cell biology of embryonic migration. Birth Defects Res C Embryo Today, 2008. 84(2): p. 102-22.
[4] Mayya, C., et al., Mechanisms of Collective Cell Migration in Wound Healing: Physiology and Disease, in Wound Healing Research: Current Trends and Future Directions, P. Kumar and V. Kothari, Editors. 2021. Springer Singapore: Singapore. p. 55-74.
[5] Delgado, M.G. and A.-M. Lennon-Duménil, How cell migration helps immune sentinels. Frontiers in Cell and Developmental Biology, 2022. 10.
[6] Aceto, N., et al., Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell, 2014. 158(5): p. 1110-1122.
[7] Reisenauer, K., The Other EMT: Exploring the controversial driver of metastasis, Z. Tang, Editor. 2019: Oncobites,The Latest in Cancer Research, simplified.
[8] Esteve, D., et al., Adult Neural Stem Cell Migration Is Impaired in a Mouse Model of Alzheimer's Disease. Mol Neurobiol, 2022. 59(2): p. 1168-1182.
[9] González, D., et al., Role of WISP1 in Stellate Cell Migration and Liver Fibrosis. Cells, 2024. 13(19).
[10] Li, Y., et al., Advances in Regulating Cellular Behavior Using Micropatterns. Yale J Biol Med, 2023. 96(4): p. 527-547.
ICP備案號:
滬ICP備15057650號-1
 滬公網安備31011202005471
滬公網安備31011202005471
雷萌生物科技(上海)有限公司 保留所有版權.