劃痕實驗/細(xì)胞遷移可以使用不同的方法在細(xì)胞單層創(chuàng)建間隙(稱為“劃痕”):
插件:在細(xì)胞接種前通過將插件/模具放置在培養(yǎng)表面,來形成無殘留的空白區(qū)域/劃痕�;
刮擦:通過刮擦表面來制造人工“劃痕“機械去除細(xì)胞(劃痕分析)
阻抗:通過在指定區(qū)域施加電壓來去除細(xì)胞而創(chuàng)建間隙
有關(guān)如何創(chuàng)建間隙的更多詳細(xì)信息和方法�����,可查看此評論:
W.J. Ashby, A. Zijlstra. Established and novel methods of interrogating two-dimensional cell migration. Integr Biol 2012, 10.1039/c2ib20154b
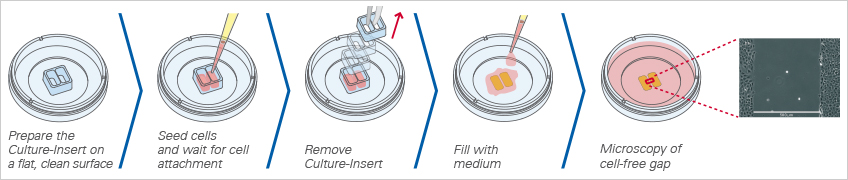
使用ibidi劃痕插件創(chuàng)建間隙
ibidi提供三種不同規(guī)格的劃痕插件用于間隙的創(chuàng)建:ibidi有2孔��、3孔和4孔插件(也有預(yù)置了2孔�、3孔和4孔插件的培養(yǎng)皿)��。由于特殊的底部(靜電黏附底部)設(shè)計�,插件(生物相容硅膠材料)可粘附在培養(yǎng)器皿的表面�。移除插件后,可形成無細(xì)胞殘留的空白間隙��。此種方法使得在沒有任何細(xì)胞殘留的情況下���,可重復(fù)地產(chǎn)生高度限定的空白間隙�。
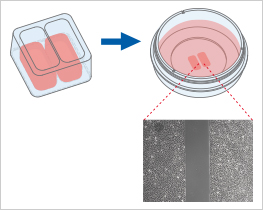
當(dāng)放置在平滑、干燥的表面上時�����,Culture-Insert 2 Well提供兩個用于培養(yǎng)細(xì)胞的儲液池���,兩個儲液池由500μm厚的壁隔開�����。將細(xì)胞接種到儲液池中并培養(yǎng)直至細(xì)胞附著并形成單層��,從表面移除硅膠插件后會產(chǎn)生兩個被插件中間壁隔開的精確定義的寬度完全相同的細(xì)胞區(qū)塊。現(xiàn)在可以通過使用活細(xì)胞成像或在不同時間點拍攝照片來監(jiān)測細(xì)胞遷移�。
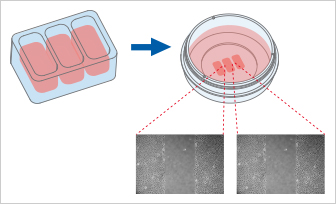
Culture -Insert 3 Well提供三個細(xì)胞培養(yǎng)池���?���?蓜?chuàng)建兩個各500 µm的無細(xì)胞間隙��,因此適合分析兩個技術(shù)重復(fù)或不同細(xì)胞類型的遷移�。
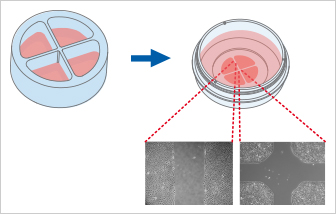
Culture -Insert 4 Well提供四個細(xì)胞培養(yǎng)池�。除了四個500 µm無細(xì)胞間隙外,還可產(chǎn)生一個1mm的中心間隙�����。Culture-Insert 4 Well可最多觀察四個技術(shù)重復(fù)或不同細(xì)胞類型的遷移�。
使用ibidi Culture-Insert 4 Well進行傷口愈合和遷移測定
ibidi 3孔/4孔兩者都可以在藥物治療或基因沉默/過度表達(dá)(例如,通過 CRISPR/Cas9���、siRNA、mRNA)后進行細(xì)胞遷移分析�����。重要的是���,未經(jīng)處理的對照細(xì)胞可以在同一容器中接種和分析���,共享相同的培養(yǎng)基�。
與其他間隙產(chǎn)生技術(shù)不同,ibidi劃痕插件系列產(chǎn)品還適用于2D侵襲實驗和同時使用兩種、三種甚至四種細(xì)胞類型或處理的共培養(yǎng)實驗�����。
通過刮擦創(chuàng)造間隙
進行劃痕測定時���,細(xì)胞會生長直至形成單層�。然后,用移液管尖端或針頭手動刮擦細(xì)胞表面以產(chǎn)生傷口��。通過在不同時間點拍攝照片或活細(xì)胞成像來監(jiān)測傷口閉合和細(xì)胞遷移����。
關(guān)于再現(xiàn)性�,該方法有一定的缺點:
間隙的寬度在很大程度上取決于施加到移液器尖端的壓力和其尺寸。
刮擦?xí)圆豢蓮?fù)制的方式去除表面涂層。這改變了細(xì)胞在該區(qū)域的粘附和遷移���。
去除的細(xì)胞以不可重現(xiàn)的方式在劃痕邊緣形成活細(xì)胞和死細(xì)胞團。活細(xì)胞的擴散會覆蓋遷移的速度。
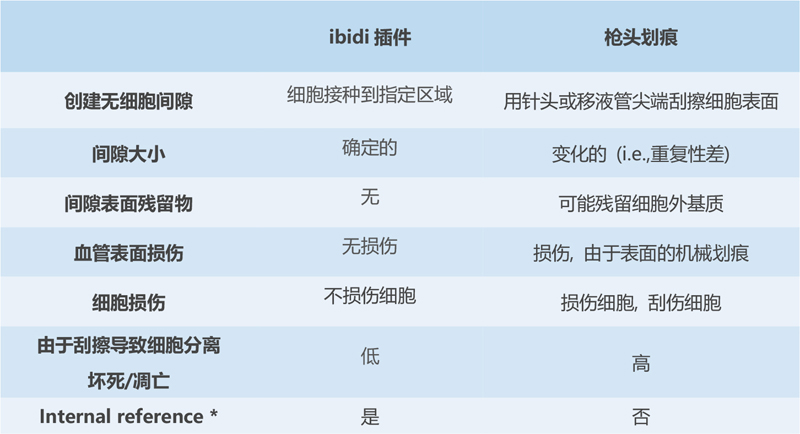
乍一看,槍刮和放置插件的方法似乎是兩種非常相似的創(chuàng)建無細(xì)胞間隙的方法�����。然而���,仔細(xì)觀察�,這兩種方法可能在重要檢測結(jié)果方面的影響存在差異:
與槍頭劃痕檢測相比,ibidi劃痕插件可提供更高的重現(xiàn)性
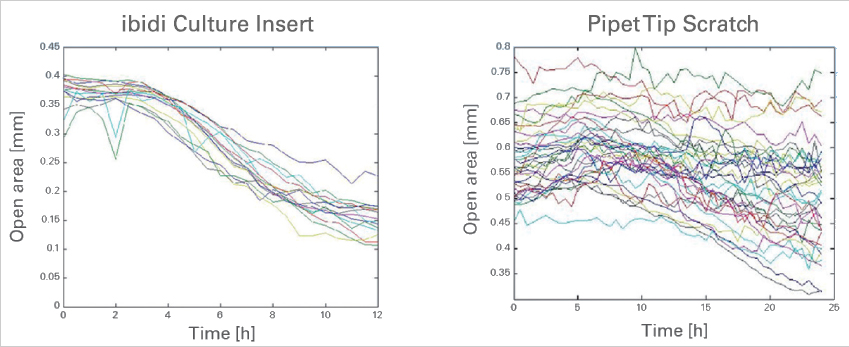
細(xì)胞遷移導(dǎo)致開放區(qū)域隨時間變化����。使用ibidi Culture-Insert 2 well(左)和使用移液器吸頭刮擦(右)產(chǎn)生間隙的對比���。數(shù)據(jù)來源:德國弗萊堡大學(xué)的M. Börries�����。
使用阻抗的劃痕實驗
ECIS傷口愈合實驗取代了傳統(tǒng)的劃痕實驗。ECIS System不是用移液管尖端機械地破壞細(xì)胞層�����,然后用顯微鏡跟蹤細(xì)胞的遷移��,而是使用電信號對傷口進行監(jiān)測���,然后監(jiān)測愈合過程��?;谧杩沟膫谟蠈嶒灥膬?yōu)點包括:
•可同時進行多達(dá)96次傷口愈合實驗
•直接推導(dǎo)時間常數(shù)和傷口愈合速度
•經(jīng)濟高效的篩選應(yīng)用,從低通量到高通量
電擊傷前(左)和電擊傷后(右)的細(xì)胞層�����。圓圈標(biāo)記電極區(qū)域,此處細(xì)胞暴露在電中
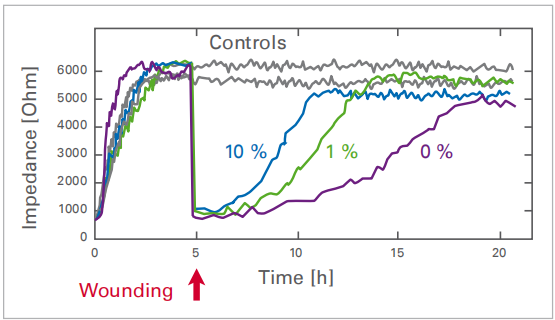
在與250μm電極接觸的一小群細(xì)胞上進行點擊傷�,從而產(chǎn)生明確的傷口����。損傷區(qū)域內(nèi)的細(xì)胞密度由阻抗反映����,由ECIS系統(tǒng)連續(xù)測量。受傷后�����,電極周圍的健康細(xì)胞立即遷移并取代電極上的死細(xì)胞����,導(dǎo)致測量阻抗值的變化。根據(jù)細(xì)胞培養(yǎng)基中胎牛血清(FCS)的濃度����,在10����、13或20小時后再次達(dá)到原始細(xì)胞密度���。
對與250µm電極接觸的少量細(xì)胞進行電損傷���,從而形成明確的傷口����。受傷區(qū)域內(nèi)的細(xì)胞密度由阻抗反映��,該阻抗由ECIS系統(tǒng)連續(xù)測量�����。受傷后,電極周圍的健康細(xì)胞立即遷移并替換電極上的死細(xì)胞��,導(dǎo)致測量阻抗值發(fā)生變化����。根據(jù)細(xì)胞培養(yǎng)基中胎牛血清(FCS)的濃度,在10����、13或20小時后再次達(dá)到原始細(xì)胞密度���。
在細(xì)胞培養(yǎng)基中使用不同濃度(0%����、1%和10%)的FCS對時間依賴性傷口閉合進行基于阻抗的分析
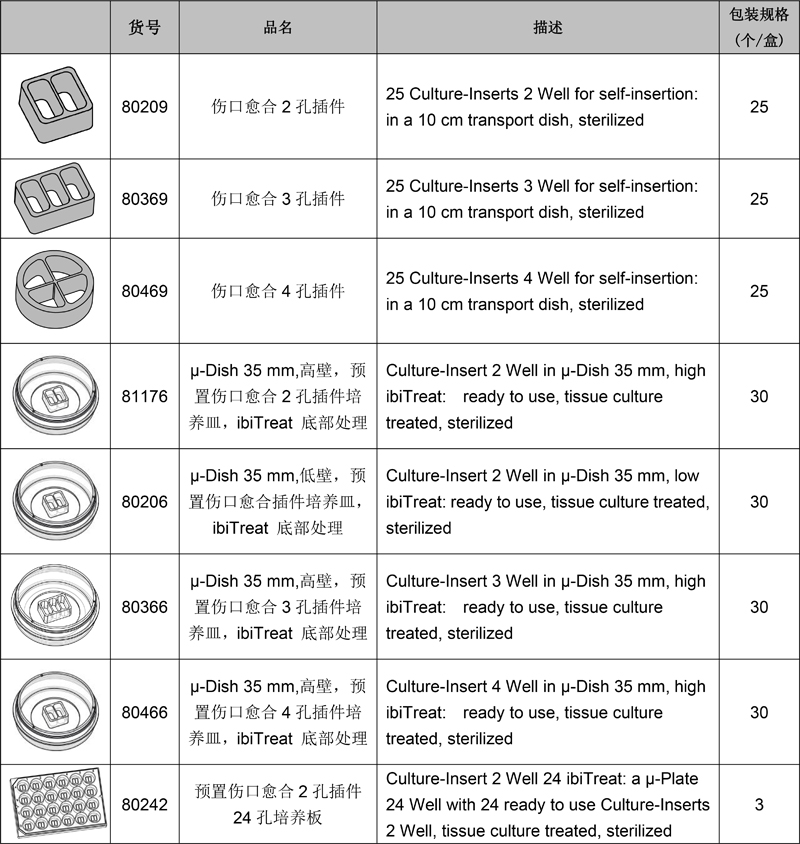
訂購信息




 滬公網(wǎng)安備31011202005471
滬公網(wǎng)安備31011202005471